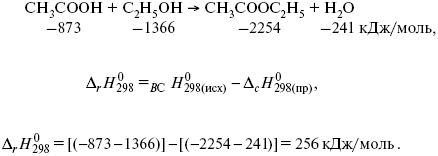
Закон Гесса – один из основных законов химии, который позволяет предсказывать изменение энтальпии реакции с помощью известных значений энтальпии ее компонентов. Этот закон был сформулирован немецким химиком Германом Гессом в 1840 году и является фундаментальным инструментом в изучении химических реакций.
Основное определение закона Гесса состоит в том, что энтальпия изменения состояния системы зависит только от начального и конечного состояний, а не от пути, которым она достигается. Другими словами, энтальпия реакции может быть определена как сумма энтальпий реакций, в которых участвуют те же самые вещества, но коэффициенты стехиометрического уравнения их переноса различны.
Применение закона Гесса позволяет рассчитать энтальпию реакции, которая не может быть непосредственно измерена, с использованием уже известных значений энтальпий реакций, которые могут быть экспериментально определены. Таким образом, закон Гесса позволяет сэкономить время и ресурсы на проведении многочисленных экспериментов и упростить изучение сложных химических реакций.
Закон Гесса в химии
Согласно закону Гесса, энергия реакции может быть выражена суммой энергий реакций, которые приводят изначальные вещества к конечным продуктам. Это означает, что энергия реакции зависит только от состояний начальных и конечных веществ, но не от промежуточных стадий реакций.
Закон Гесса имеет важное практическое применение в химической термодинамике. Он позволяет определить изменение энтальпии реакции по известным значениям энтальпий реакций, проходящих при других условиях. Также закон Гесса может быть использован для прогнозирования химических реакций и определения энергии связи между атомами.
Примером применения закона Гесса может служить реакция сгорания метана:
CH4 + 2O2 → CO2 + 2H2O
Энергия реакции сгорания метана может быть определена с использованием значений энергий реакций, проходящих по другим путям. Например, реакцией 2H2 + O2 → 2H2O.
Закон Гесса является важным инструментом для понимания и анализа термодинамических свойств химических реакций. Он позволяет предсказывать энергетические изменения, происходящие при различных условиях, и играет важную роль в разработке новых химических процессов и материалов.
Определение закона Гесса
Закон Гесса в химии утверждает, что изменение энтальпии (тепловое изменение) реакции не зависит от пути ее осуществления, а зависит только от начального и конечного состояний системы. Это означает, что вне зависимости от того, каким образом происходит реакция, суммарное изменение энтальпии будет одинаковым, если начальные и конечные условия остаются неизменными.
Закон Гесса является следствием принципа сохранения энергии, согласно которому полное тепловое изменение системы равно сумме изменений для каждой стадии реакции.
Закон Гесса имеет большое значение в химических расчетах, поскольку позволяет определить изменение энтальпии для реакции, используя данные о реакциях, которые легче измерить или вычислить.
Одним из применений закона Гесса является определение теплового эффекта при невозможности его прямого измерения. Это достигается путем разделения реакции на более простые стадии, для которых тепловые эффекты известны.
| Примеры реакций, демонстрирующих закон Гесса: |
|---|
|
Формулировка закона Гесса
Закон Гесса в химии устанавливает, что величина теплового эффекта (тепла образования, тепла реакции и т.д.) в химической реакции не зависит от пути, по которому происходит эта реакция, а зависит только от исходных и конечных состояний системы.
Другими словами, закон Гесса утверждает, что если химическая реакция может быть разделена на несколько последовательных этапов (промежуточных реакций), то изменение энтальпии каждого этапа равно сумме изменений энтальпий для всех этапов, и окончательное изменение энтальпии реакции также равно сумме изменений энтальпий для каждого этапа.
Этот закон позволяет вычислять тепловые эффекты химических реакций, используя термохимические данные для других реакций, о которых легче провести измерения.
Например, для определения энтальпии реакции, которая не может быть измерена прямым экспериментом, можно использовать известные значения энтальпий для других химических реакций, которые могут быть измерены. С помощью закона Гесса можно проследить путь от начальных реагентов к конечному продукту, разбив его на несколько этапов, и рассчитать изменение энтальпии каждого этапа. Затем сумма всех этих изменений энтальпий будет равна изменению энтальпии исходной реакции.
Суть закона Гесса
Закон Гесса может применяться для определения энергии различных термохимических процессов, например, для рассчета изменения энтальпии в реакциях. Также этот закон позволяет определить тепловые эффекты реакций, которые не могут быть измерены прямыми методами.
Примером применения закона Гесса может служить реакция сгорания метана. Для определения теплового эффекта этой реакции в эксперименте можно использовать несколько методов, например, измерение изменения температуры или использование калориметра. С помощью закона Гесса можно также рассчитать этот эффект, если известны тепловые эффекты других реакций, например, реакций сгорания метанола или графита.
Применение закона Гесса
Применение закона Гесса особенно полезно для определения энтальпии реакций, так как позволяет расчитывать изменение энергии при конкретном термодинамическом цикле реакций. Используя известные значения энергии реакций, мы можем определить энергию реакции, которую исследуем. На практике это означает, что мы можем предсказывать, какой температуры будет реакция и какие вещества будут образованы или потребованы.
Применение закона Гесса также помогает нам заменять трудноизмеримые реакции, относящиеся к расщеплению сложных соединений на элементарные шаги реакции, простыми реакциями. Например, мы можем расчитать энергию продукции от сгорания бензола, путем сравнения реакций сгорания бензола постепенно на нагреве метана и графита. В результате мы получаем изменение энергии реакции сгорания бензола без непосредственного проведения данной реакции.
Кроме того, закон Гесса применяется в разных областях химии, включая органическую и неорганическую химию, физическую химию и биохимию. Он широко используется для расчетов в рамках термодинамики химических процессов и позволяет углублять наши знания о химических реакциях и структуре веществ.
Расчет энталпии реакции
Основной метод расчета энталпии реакции заключается в использовании известных значений энталпии образования веществ, входящих в реакцию, и энталпии разложения веществ, образующихся в результате реакции.
Для расчета энталпии реакции применяются следующие шаги:
- Составление химического уравнения для реакции.
- Определение энталпий образования веществ, входящих в реакцию, и энталпий разложения веществ, образующихся в результате реакции.
- Установление необходимого количества молей каждого вещества, участвующего в реакции.
- Расчет энталпии реакции путем вычитания энталпий разложения из энталпий образования и умножения результатов на соответствующие коэффициенты в химическом уравнении реакции.
Расчет энталпии реакции позволяет определить тепловой эффект данной химической реакции. Этот показатель может быть полезен при оптимизации процессов в химической промышленности, а также при проведении экспериментов в лаборатории.
Определение стандартной энталпии образования
Стандартная энтальпия образования используется для измерения энергии, выделяющейся или поглощаемой при химической реакции. Она является важной характеристикой вещества и позволяет определить, насколько реакция будет энергетически благоприятной.
Значение стандартной энтальпии образования зависит от состояния элементарных веществ, из которых образуется исследуемое вещество. Для каждого химического вещества существует своя стандартная энтальпия образования, которая выражается в джоулях на моль.
Стандартную энталпию образования можно использовать для расчета теплового эффекта реакции с помощью закона Гесса. Это позволяет определить, достигнет ли реакция химического равновесия при заданных условиях.
Использование закона Гесса для определения энтальпий реакций
Закон Гесса в химии играет важную роль при определении энтальпий реакций. Закон Гесса гласит, что изменение энтальпии в химической реакции определяется разницей между начальным и конечным состояниями реагентов и продуктов и не зависит от пути или механизма реакции.
Использование закона Гесса для определения энтальпий реакций часто основывается на принципе «первые принципы» термодинамики и заключается в разбиении реакции на несколько более простых реакций. Это позволяет определить энтальпию реакции путем сложения энтальпий этих простых реакций.
Допустим, у нас есть химическая реакция, для которой нам нужно определить энтальпию. Мы можем использовать закон Гесса, разбив реакцию на ряд простых стадий, для которых энтальпии могут быть определены или известны. Затем мы можем сложить эти энтальпии, чтобы получить общую энтальпию реакции.
Например, рассмотрим реакцию горения метана (обратите внимание, что это упрощенный пример):
CH4 + 2O2 -> CO2 + 2H2O
Вместо непосредственного измерения энтальпии этой реакции, мы можем разбить ее на две простые реакции: сначала горение графита и затем горение водорода:
С + 2O2 -> CO2
H2 + 1/2O2 -> H2O
Затем мы можем использовать известные энтальпии данных простых реакций для определения общей энтальпии реакции горения метана. В этом случае мы могли бы использовать таблицу значений энтальпий образования для определения известных энтальпий каждой реакции и сложить их для получения энтальпии реакции горения метана.
Вопрос-ответ:
Что такое закон Гесса?
Закон Гесса в химии утверждает, что изменение энтальпии (теплоты) в химической реакции не зависит от пути, по которому происходит реакция, а зависит только от начального и конечного состояний системы.
Как применяется закон Гесса в химии?
Закон Гесса применяется для расчета энтальпии реакции, когда непосредственное измерение невозможно. С помощью этого закона можно определить энергию реакций, включающих в себя неизвестные вещества или состояния.
Можете привести пример применения закона Гесса?
Например, у нас есть реакция сгорания метана, но измерить энтальпию непосредственно сложно. Мы знаем, что метан можно получить приоритетно из графита и водорода, а также он может образовываться при гидрировании углерода. Мы можем измерить энтальпии образования графита, водорода и метана, и затем, используя закон Гесса, определить энтальпию сгорания метана.
Какие основные положения закона Гесса можно выделить?
Основные положения закона Гесса: изменение энтальпии (теплоты) реакции не зависит от пути, по которому происходит реакция; изменение энтальпии реакции зависит только от начального и конечного состояний системы; закон Гесса применим как для реакций, происходящих в одной стадии, так и для реакций, происходящих в нескольких этапах.
Какие еще примеры применения закона Гесса в химии можно привести?
Еще один пример применения закона Гесса — расчет стандартной энтальпии образования вещества. Если мы знаем энтальпии образования ряда других веществ и разлагаемого состава, то с помощью закона Гесса можно найти энтальпию образования этого состава.
Что такое Закон Гесса?
Закон Гесса в химии — это фундаментальный закон, который утверждает, что изменение теплоты реакции не зависит от пути, по которому происходит реакция.
Какой пример можно привести для Закона Гесса?
Например, при горении метана реакцию можно разбить на два этапа: сначала метан разлагается на угарный газ и воду, а затем угарный газ и вода сгорают, образуя углекислый газ и воду. В результате, изменение энтальпии горения метана будет равно сумме изменений энтальпий обоих этапов.