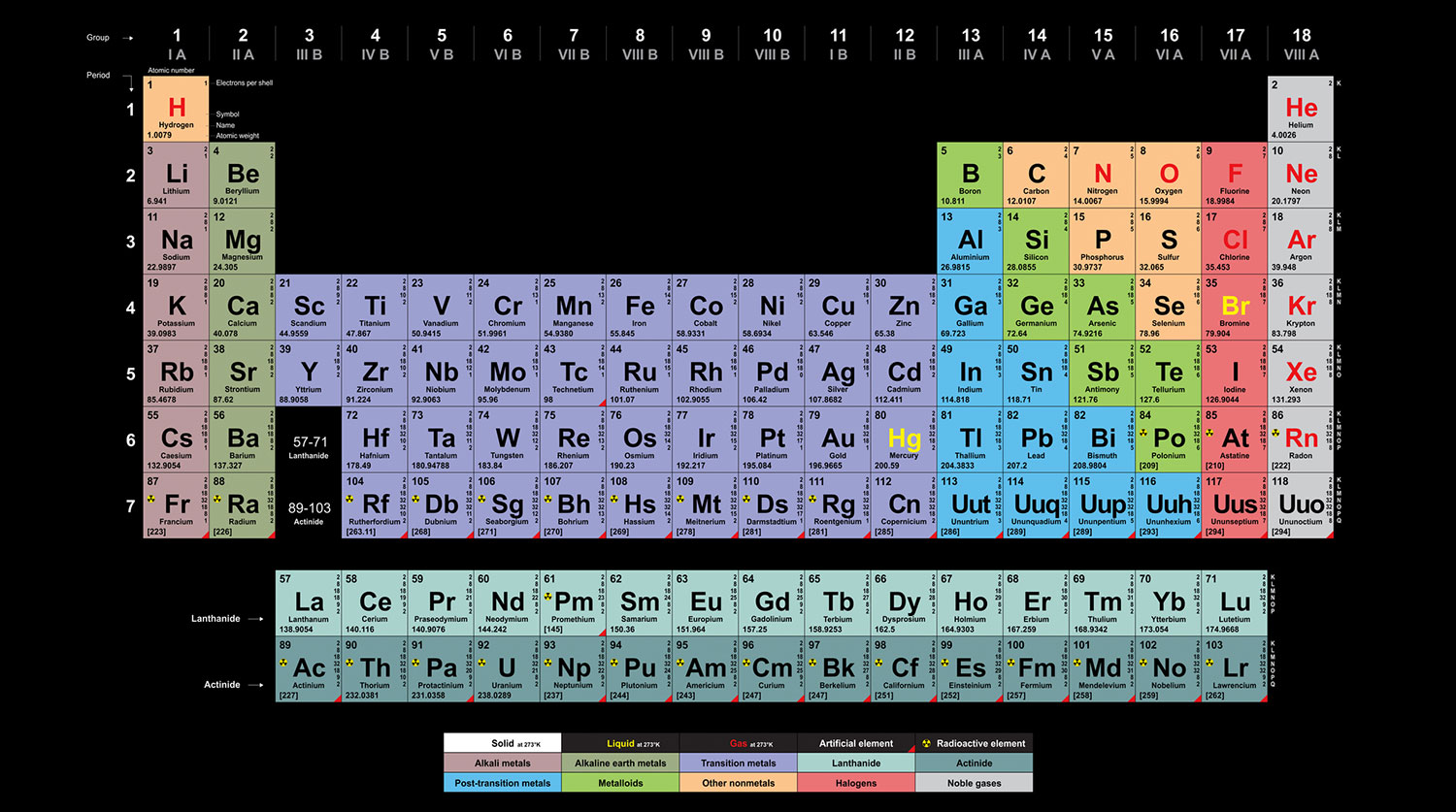
Периодическая система химических элементов Менделеева – это основная организационная схема, используемая в химии для классификации и систематизации всех известных элементов. Закон периодической системы, предложенный русским химиком Дмитрием Ивановичем Менделеевым в 1869 году, основан на нескольких принципах и имеет глубокое значение для науки и технологий.
Основными принципами закона периодической системы Менделеева являются следующие:
- Упорядочение элементов. В периодической системе элементы упорядочены по порядку возрастания атомных номеров. Порядковый номер каждого элемента соответствует количеству протонов в его атомном ядре. Элементы разделены на группы и периоды в зависимости от сходства химических свойств.
- Периодичность свойств. Закон периодической системы устанавливает, что свойства химических элементов повторяются периодически с увеличением их атомных номеров. Это означает, что элементы в одной группе имеют схожие химические свойства и могут образовывать аналогичные химические соединения.
- Предсказание отсутствующих элементов. Благодаря закону периодической системы, Менделеев смог предсказать свойства и существование ряда элементов, которые еще не были открыты на момент составления его таблицы. После открытия этих элементов, они были добавлены в периодическую систему и точность ее предсказаний была подтверждена.
Закон периодической системы Менделеева имеет огромное значение для науки и технологий. Он позволяет химикам систематизировать и классифицировать элементы, анализировать их химические свойства и взаимодействия. Знание периодической системы является основой для понимания химических процессов, разработки новых материалов и прогнозирования свойств новых элементов. Благодаря закону периодической системы, ученые постоянно расширяют наши знания о химии и открывают новые возможности для развития науки и технологий во благо человечества.
Закон периодического системы Менделеева
Основной принцип закона периодической системы Менделеева заключается в том, что химические элементы, отсортированные по возрастанию атомного номера, имеют сходные химические свойства и могут быть группированы в вертикальные столбцы – группы. Каждый элемент в периодической системе Менделеева имеет свое уникальное атомное число, обозначаемое в таблице символами от 1 до 118.
В таблице периодической системы Менделеева элементы также располагаются в горизонтальных рядах – периодах – в порядке возрастания атомной массы. Периодическая закономерность, которую Менделеев обнаружил, заключается в том, что свойства элементов повторяются с некоторым циклическим смещением периодов. Это объясняется последовательным увеличением количества электронных оболочек, заполняющих энергетические уровни атома, и изменением электронной конфигурации.
Значение закона периодической системы Менделеева состоит в его способности предсказывать недостающие элементы и раскрывать закономерности в химических свойствах элементов. Благодаря этому, было возможно заполнение пробелов в таблице периодической системы Менделеева и открытие новых элементов, которые ранее не были известны.
Закон периодической системы Менделеева является фундаментальным для изучения химии и является основой для понимания свойств и реакций различных химических элементов. Он помогает организовать знания и систематизировать информацию о химических элементах, что делает его неотъемлемой частью химической науки.
Основные принципы
Первый принцип: Закон периодической системы Менделеева основывается на разделении элементов по их атомным номерам, которые определяют количество протонов в ядре атома. Элементы располагаются в порядке возрастания атомного номера.
Второй принцип: Периодическая система Менделеева состоит из периодов и групп. Периоды представляют собой горизонтальные строки, а группы — вертикальные столбцы элементов. Каждая группа имеет общие свойства, такие как аналогичную электронную конфигурацию.
Третий принцип: В периодической системе Менделеева закономерно повторяются химические свойства элементов внутри каждой группы. Это объясняется тем, что элементы в одной группе имеют одинаковое количество валентных электронов, что определяет их химическую активность и способность образовывать химические связи.
Пятый принцип: Закон периодической системы Менделеева является основой для проведения химических исследований, разработки новых материалов и прогнозирования реакций и процессов, происходящих в химических системах.
Шестой принцип: В периодической системе Менделеева имеются места под неизвестные элементы, которые впоследствии были открыты и заполнили пробелы в таблице. Это подтверждает стабильность и важность данного закона.
Седьмой принцип: Закон периодической системы Менделеева является основой для изучения и понимания химии элементов и их соединений, а также позволяет классифицировать и систематизировать большое количество информации о химических взаимодействиях.
Химические элементы упорядочены по атомному номеру
В периодической системе Менделеева все химические элементы упорядочены по атомному номеру. Атомный номер каждого элемента определяется количеством протонов в его ядре. Чем больше атомный номер, тем больше протонов и электронов содержит атом элемента.
Атомный номер постепенно увеличивается от легких элементов, таких как водород (Z=1) и гелий (Z=2), до самых тяжелых элементов, таких как уран (Z=92) и плутоний (Z=94). Эта систематическая организация позволяет ученым классифицировать и изучать свойства элементов и прогнозировать химические связи и реакции веществ.
Периодическая система Менделеева становится основой для различных отраслей науки и технологий, включая химию, физику, материаловедение, медицину и т.д. Эта система является одной из самых важных достижений в истории науки и способствует развитию современной химии и ее приложений.
Элементы схожих химических свойств располагаются вертикально
Основная идея закона периодической системы Менделеева заключается в том, что элементы схожих химических свойств располагаются вертикально внутри таблицы. В периодической системе химических элементов химические свойства элементов периодически повторяются, образуя периоды и группы.
Периоды — это строки таблицы, где элементы размещены в порядке возрастания их атомных номеров. Каждый последующий период начинается с новой энергетической оболочки, в которой находятся электроны. Периоды определяют количество энергетических оболочек у атомов элементов. Кроме того, периоды можно также разделить на несколько блоков: s-блок, p-блок, d-блок и f-блок, каждый из которых представлен различными элементами.
Группы — это столбцы таблицы, в которых элементы имеют схожие химические свойства. В каждой группе элементы имеют одинаковое количество электронов во внешней энергетической оболочке, что делает их химически похожими друг на друга. Некоторые группы элементов имеют специальные названия, такие как щелочные металлы, щелочноземельные металлы, галогены и инертные газы.
Расположение элементов схожих химических свойств вертикально в периодической системе позволяет нам сделать предположения о химических свойствах новых элементов, а также найти закономерности в химических реакциях и соединениях. Это делает периодическую систему Менделеева не только удобным средством для классификации элементов, но и мощным инструментом в изучении химии.
| Группы | Химические свойства |
|---|---|
| 1 | Щелочные металлы |
| 2 | Щелочноземельные металлы |
| 17 | Галогены |
| 18 | Инертные газы |
Поперечные ряды образуют периоды
Периоды — это строки химических элементов, расположенные горизонтально в таблице Менделеева. Каждый период начинается с щелочного металла и заканчивается инертным газом. Количество элементов в каждом периоде определяется квантовыми уровнями энергии электронов в атоме. Это означает, что каждый период соответствует заполнению одного квантового уровня электронами.
Кроме того, внутри каждого периода элементы можно разделить на несколько подгрупп или поперечных рядов. Каждый поперечный ряд начинается с щелочного металла и заканчивается инертным газом. Внутри периода поперечные ряды ведут себя аналогично группам элементов.
Поперечные ряды в периодической системе Менделеева имеют большое значение, поскольку они позволяют классифицировать элементы на основе их химических и физических свойств. Каждый поперечный ряд имеет свои особенности, связанные с электронной конфигурацией и химическими свойствами элементов в нем. Изучение периодической системы Менделеева и поперечных рядов помогает химикам и физикам понять закономерности и связи между элементами и предсказывать их химическое поведение.
Значение закона
Закон периодической системы Менделеева имеет огромное значение в химии и научном мире в целом. Его значимость состоит в следующем:
- Систематизация элементов: Закон Менделеева позволяет упорядочить все известные элементы в периодическую таблицу, основанную на их атомных номерах и химических свойствах. Это облегчает изучение и понимание связей между различными элементами и их характеристиками.
- Предсказание новых элементов: Благодаря закону периодической системы, Менделеев смог предсказать существование и свойства еще неизвестных элементов. Его предсказания были впоследствии подтверждены открытием таких элементов, как германий и галлий. Это позволяет ученым в настоящее время предполагать и искать новые элементы на основе пустых мест в таблице.
- Определение химической реактивности: Закон периодической системы помогает предсказать химическую реактивность элементов. Он позволяет определить, какие элементы могут обменивать электроны с другими элементами, и предсказывать, какие реакции могут происходить при взаимодействии различных веществ.
- Основа для разработки новых материалов: Закон периодической системы служит основой для разработки новых материалов и соединений. С помощью этого закона ученые могут предсказывать состав и свойства новых материалов, которые могут использоваться в различных областях, таких как электроника, медицина и промышленность.
Упрощает классификацию химических элементов
Периодическая система Менделеева расшифровывает и систематизирует различные химические свойства элементов: атомные ионные радиусы, электроотрицательность, электронная конфигурация и многие другие.
Она также позволяет предсказывать свойства новых неизвестных элементов, которые еще не были открыты на момент создания системы. Это делает периодическую систему Менделеева важным инструментом для исследования и понимания химической реактивности и взаимодействий элементов.
Классификация химических элементов в периодической системе Менделеева основана на их свойствах и периодичности, которые отражены в основном законе периодической системы – законе Менделеева. Каждый элемент занимает свое место в таблице, расположенной в соответствии с орбитальными оболочками и энергией электронов.
Вопрос-ответ:
Какие основные принципы лежат в основе закона периодической системы Менделеева?
Основными принципами закона периодической системы Менделеева являются следующие: элементы располагаются по возрастанию атомных номеров, элементы с похожими химическими свойствами группируются в одной вертикальной колонке, элементы в периоде располагаются в порядке возрастания атомных номеров, свойства элементов меняются постепенно при движении слева направо по периодам, свойства элементов повторяются при движении сверху вниз по группам.
Какое значение имеет закон периодической системы Менделеева?
Закон периодической системы Менделеева имеет огромное значение для химии и науки в целом. Он упорядочивает все известные элементы и помогает установить связи между ними. Закон периодической системы позволяет предсказывать химические свойства новых элементов и их соединений, а также разрабатывать новые методы синтеза веществ. Благодаря этому закону, химики могут экономить время и ресурсы при исследовании и применении химических веществ.
Почему элементы в периодической таблице располагаются по возрастанию атомных номеров?
Элементы в периодической таблице располагаются по возрастанию атомных номеров, так как атомный номер каждого элемента равен количеству протонов в его ядре. Поэтому, с увеличением атомного номера, увеличивается и количество электронов в атоме. Это позволяет определить электронную конфигурацию элемента и его химические свойства.
Как можно объяснить повторение свойств элементов при движении сверху вниз по группам периодической таблицы?
Повторение свойств элементов при движении сверху вниз по группам периодической таблицы можно объяснить изменением радиуса атома. Периодическая система Менделеева основана на разделении элементов на группы и периоды в зависимости от электронной конфигурации атомов. При движении вниз по группе, количество энергетических уровней увеличивается, что влияет на размер атома. С увеличением радиуса атома, меняются и химические свойства элемента.
Какой основной принцип лежит в основе закона периодической системы Менделеева?
Основной принцип закона периодической системы Менделеева заключается в том, что свойства химических элементов периодически повторяются при упорядоченной расстановке элементов по возрастанию атомных номеров.
Какая польза от закона периодической системы Менделеева?
Закон периодической системы Менделеева имеет огромную практическую пользу, поскольку он позволяет систематизировать и классифицировать все известные химические элементы. Это помогает химикам понять основные закономерности взаимодействия элементов, предсказывать их свойства и разрабатывать новые вещества и материалы.